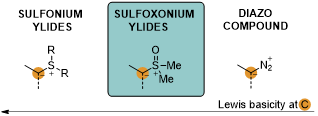
锍叶立德作为两性离子化合物,一般需要在叶立德Cα-位引入吸电子基来稳定其存在。此外,根据硫原子氧化态的不同,可以分为sulfonium ylide(正锍叶立德)与sulfoxonium ylide(氧化锍叶立德)两大类。电负性氧原子的引入,不仅使得氧化锍叶立德的叶立德碳Lewis碱性降低,而且具Lewis碱性的氧原子或副产物DMSO容易与手性催化剂结合,从而可能对反应过程中的手性诱导产生干扰。但与正锍叶立德以及类似的重氮化合物相比,氧化锍叶立德具有良好的稳定性,之前报道的绝大多数文献都将其作为重氮化合物的替代物经金属卡宾中间体应用于有机合成。因此,发展基于锍叶立德不对称催化研究具有重要意义。
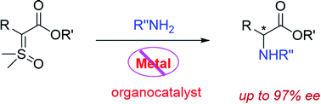
在前期研究的基础上(J. Am. Chem. Soc. 2020, 142, 14384),郭文岗博士与孙建伟教授、黄海教授团队合作,实现了手性磷酸催化反应条件下氧化锍叶立德的不对称N-H插入反应,反应具有较宽的底物范围,并且适用于含强吸电子取代基的芳胺底物。
机理研究证明该反应体系具有如下特征:
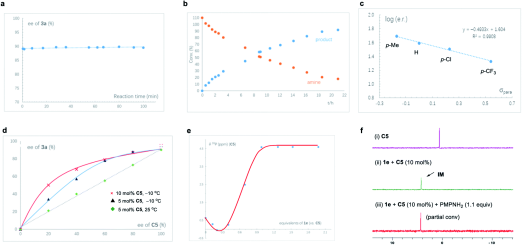
(1)反应机理基于动态动力学拆分,C-N的生成既是反应决速步又是对映体选择决定步,芳环上给电子取代基对ee值控制有利;
(2)氧化锍叶立德Cα较低的Lewis碱性,避免了手性磷酸烷基化失活,使得反应具有较宽的底物范围。
此外,反应体系(特别是手性诱导)对水、氧气、底物浓度、催化剂使用量不敏感,凸显了有机催化在该反应体系中的优势。
该成果最近以“Organocatalytic asymmetric synthesis of α-amino esters from sulfoxonium ylides”为题发表于《化学科学》(Chemical Science),welcome欢迎光临威尼斯公司为论文第一完成单位,welcome欢迎光临威尼斯公司新引进青年教师郭文岗博士为论文第一作者,孙建伟教授和黄海教授为论文通讯联系人。文章链接:https://pubs.rsc.org/en/content/articlelanding/2021/sc/d1sc02439f



