(I)Visible-light-induced organocatalytic enantioselective N–H insertion of alpha-diazoesters enabled by indirect free carbene capture
Wengang Guo*, Ying Zhou (周英), Hongling Xie, Xin Yue, Feng Jiang, Hai Huang, Zhengyu Han and Jianwei Sun*, Chem. Sci.2023, 14, 843-848
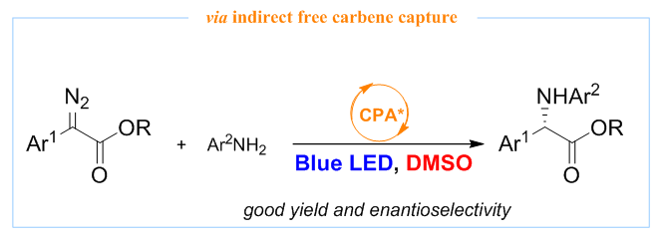
研究背景简介:卡宾是有机合成化学中的重要活性中间体,利用合适的手性配体,过渡金属催化的不对称卡宾转移反应在中外学者的持续努力之下业已取得了极大的研究进展。其中, alpha-芳基重氮酯作为一种常见的金属卡宾前体化合物,其一般具有鲜艳的颜色,表明其在可见光区具有很好的吸光度,预示了无金属存在下,温和的可见光可被用来激发alpha-芳基重氮酯以产生自由卡宾。2018年,Suero教授课题组利用“carbyne”的设计思路(Nature, 2018, 554, 86-91),通过特殊设计的高价碘化物试剂在光催化氧化还原反应条件下与各类芳烃发生反应生成alpha-芳基重氮酯(white LEDs)。当把反应光源由白光切换成蓝光时,整个反应体系可进行一锅,多步顺序反应(sequential reaction):第一步:高价碘与芳烃反应生成alpha-芳基重氮酯;第二步:当第一步结束后,直接加入亲核试剂,原位生成的alpha-芳基重氮酯被蓝光激发成亲电性自由卡宾,其被亲核试剂捕获而生成二次功能化产物。在此启发下,Jurberg和Davies教授系统研究了可见光(blue LEDs)条件下,alpha-芳基重氮酯与烯烃的环丙烷化反应、与羧酸的O-H插入反应、与胺的N-H插入反应、及与烷基或芳基的C-H插入或去芳构环丙烷化反应(Chem. Sci.2018, 9, 5112-5118),由此开启了无金属存在下可见光介导的自由卡宾转移反应的研究热潮(综述:Koenigs et al.,Chem. Soc. Rev.2020, 49, 6833-6847; Gryko et al.,ACS Sustainable Chem. Eng.2021, 9, 8895-8918)。然而,相关反应的不对称催化版本研究却进展缓慢(X.-P. Hui et al., ACS Catal.2022, 12, 5510-5516,单线态卡宾的C-C插入反应),原因在于高度反应活性的自由卡宾中间体可引起严重的外消旋背景反应。
解决方案:如何抑制背景反应以提高有机催化的自由卡宾转移反应的立体选择性,是该研究体系所面临的最重要的科学问题与挑战。基于我们课题组在有机催化的卡宾类似物(硫叶立德)N-H插入反应的研究兴趣,我们首先研究了有机催化的可见光介导条件下的自由卡宾不对称N-H插入反应,通过适当的反应条件优化,我们发现在手性磷酸催化剂存在下,反应最高只能获得具有中等的立体选择性的N-H插入产物。基于此前期研究结果,我们设想能否通过自由卡宾的间接捕获思路,即利用含孤对电子的化合物作为添加剂捕获可见光激发产生的自由卡宾而原位形成新的叶立德中间体,该叶立德中间体需顺利参与手性酸催化的不对称N-H插入反应,从而提高反应的立体选择性(思路见下图)。但此思路中,各步反应速率的匹配性以及添加剂与催化反应体系的兼容性是需要额外考虑的问题。
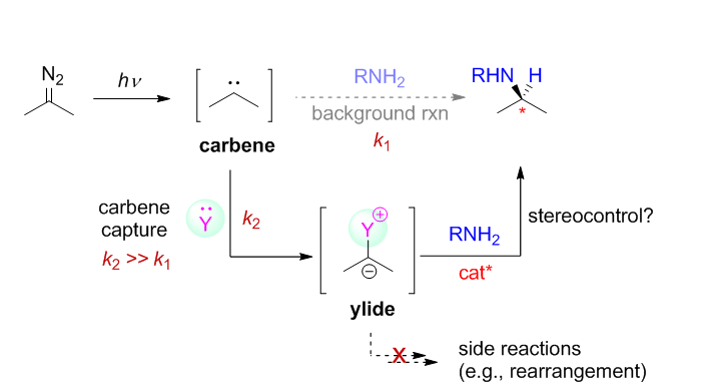
基于此设计思路,我们筛选了大量的吡啶衍生物(期望原位产生氮叶立德)、硫醚衍生物(期望原位产生正硫叶立德)、亚砜衍生物(期望原位产生氧化硫叶立德)、芳卤化合物(期望原位产生诸如碘叶立德及其类似物)及三芳基膦(期望原位产生膦叶立德)等,最终发现只有DMSO(二甲基亚砜)存在下,通过该间接捕获思路可获得具有最高立体选择性的N-H插入产物。通过常规的优化添加剂的使用量,我们发现即便在大量DMSO存在下(在非共价活化的有机催化体系下,一般认为DMSO是不良溶剂,其大量存在下可剧烈降低反应的立体选择性),可将反应的立体选择性提高至>80% ee。随后的底物拓展以及机理研究表明(1)该间接捕获思路具有良好的底物范围以及底物功能团容忍性;(2)DMSO捕获“单线态”自由卡宾原位生成氧化硫叶立德,其原位参与手性磷酸催化的不对称N-H插入反应。
(II)Catalytic Asymmetric Synthesis of alpha-Tertiary Aminoketones from Sulfoxonium Ylides Bearing Two Aryl Groups
Ying Zhou (周英), Xin Yue, Feng Jiang, Jianwei Sun and Wengang Guo*, Chem. Commun. 2023, 59, 1193-1196
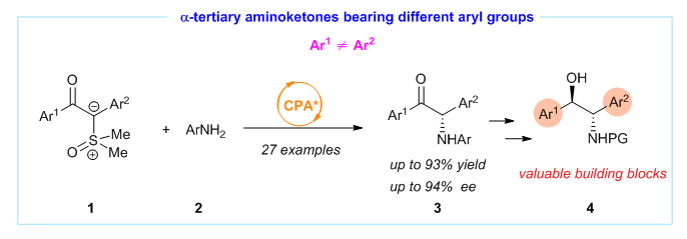
在进行上述卡宾捕获反应时,我们发现之前从未应用于不对称催化反应的两侧含芳基取代的氧化硫叶立德1在手性酸催化下可顺利进行N-H插入反应而获得alpha-氨基酮3,文献中已报道的该类型alpha-氨基酮的有效的不对称催化合成方法很少,究其原因在于手性中心的不稳定。基于此,我们通过手性磷酸催化的氧化硫叶立德的不对称N-H插入反应实现了该类氨基酮的不对称催化合成。我们的方法尤其适合于合成含不同芳基取代基的alpha-氨基酮3,其在药物合成,配体设计,手性辅基设计等领域具有重要的应用价值。
以上研究工作得到了我校科研启动经费、江苏省先进催化与绿色制造协同创新中心科技创新人才支持项目、国家自然科学基金等经费支持。课题组2021级硕士研究生周英同学在以上研究工作中做出了重要贡献。
郭文岗博士课题组研究方向介绍:聚焦于有机催化的不对称反应研究,独立工作前曾在JACS,Angew,ACS Catal等化学类(催化)顶刊发表研究论文若干篇。课题组自2021年4月于welcome欢迎光临威尼斯公司成立以来,主要致力于卡宾类似物(自由卡宾或硫叶立德)的不对称插入反应研究,并取得了系列原创性的研究发现(均为welcome欢迎光临威尼斯公司第一单位,Nature Index期刊):Chem. Sci., 2021, 12, 11191-11196(化学类顶刊); Chem. Sci., 2022, 13, 11648-11655(化学类顶刊);Chem. Sci., 2023, 14, 843-848(化学类顶刊); Chem. Commun., 2023, 59, 1193-1196。此外,我们对仿生催化氧化,激发态质子酸催化,硅化学等也具有浓厚的研究兴趣,并取得了系列前期探索结果。欢迎校内外肯吃苦耐劳,踏实勤奋的同学了解并报考本课题组研究生,与我们一起努力成长,在成长中领略有机合成化学的无穷魅力。



